|
中国西南地区的喀斯特生境孕育了独特而脆弱的生态系统,具有特殊的重要性,但关于喀斯特野生植物物种,特别是受威胁严重物种的保护基因组、遗传适应性以及抗干旱特性的综合研究仍然很少。苦苣苔科(Gesneriaceae)弥勒苣苔(Oreocharis mileensis)是分布在滇黔桂喀斯特地区的“石缝中的精灵”,因其于2006年在云南石林被重新发现,分布区狭窄且分布数量较少,受威胁严重,而被列为典型的极小种群野生植物,受到广泛关注。
 
图1 弥勒苣苔Oreocharis mileensis
极小种群野生植物综合保护团队为揭示弥勒苣苔“极小种群”的形成和维持机制,探索其在未来环境变化下的遗传适应性,以优化现有保护措施并提供科学的理论指导,在对弥勒苣苔全基因组解析基础上,对涵盖所有种群的个体开展了全基因组重测序,全面评估了其基因组多样性和遗传适应性。(1)研究团队首次构建了包含两套单倍型,大小为3.99 Gb的高质量基因组,contig N50为124 Mb,两套仅含有一个Gap。该组装揭示了弥勒苣苔复杂的进化历史:继祖先γ全基因组三倍化事件之后,发生了三次谱系特异性全基因组重复事件。(2)对来自10个分布点的107个个体进行群体基因组重测序,分析结果显示,种群之间表现出较低的遗传多样性(π值0.000285-0.000422 )、强烈的谱系划分(8个)、低基因流和高遗传分化(Fst值0.20-0.77),表明各种群之间存在长期隔离。(3)研究发现核心种群表现出较高的近交水平,而边缘种群的纯合性片段减少且携带的有害突变较少,这可能暗示了相应的种群动态事件以及潜在的清除效应。(4)为识别种群分化的驱动因素,研究团队对假定适应性位点和中性位点进行了偏冗余分析(Partial Redundancy Analysis)。结果表明,遗传变异主要与当前的种群结构相关,这意味着长期隔离和遗传漂变等种群动态历史过程是分化的主导因素。(5)对假定适应性的单核苷酸多态性(SNPs)进行功能注释,鉴定出与抗旱性和复水后快速恢复相关的基因,这些基因是复苏植物的关键性状相关基因。(6)梯度森林模型(Gradient Forest Modeling)预测,在未来气候情景下几乎所有种群都将发生显著的遗传偏移,凸显其日益增加的遗传脆弱性。(7)种群历史动态分析表明,弥勒苣苔的种群在中更新世过渡期(约0.6 Mya)和晚更新世和末次冰期(约50 Ka)经历了两次严重的下降,并在以后发生了持续下降。这些综合研究结果表明,弥勒苣苔的遗传多样性与适应潜力由历史隔离、遗传漂变与局部适应的相互作用所塑造,最终导致了较低的遗传多样性,同时种群历史动态的变化和环境变化条件下的遗传脆弱性也是导致其成为极小种群的成因,并面临着较高的灭绝风险。
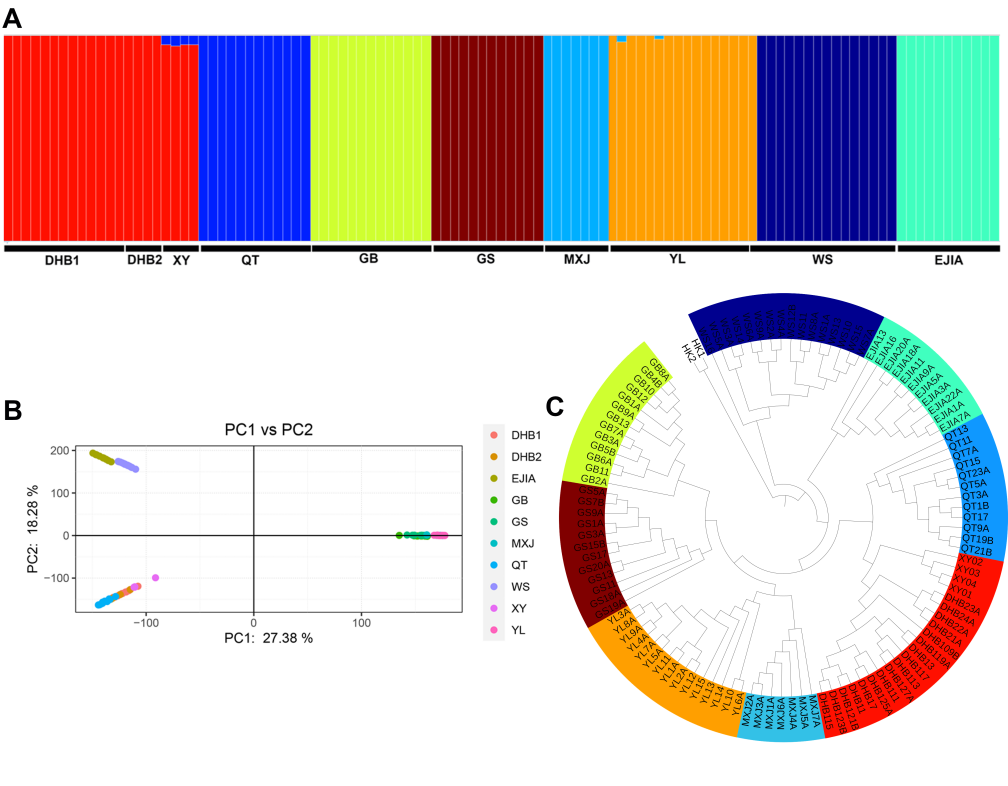 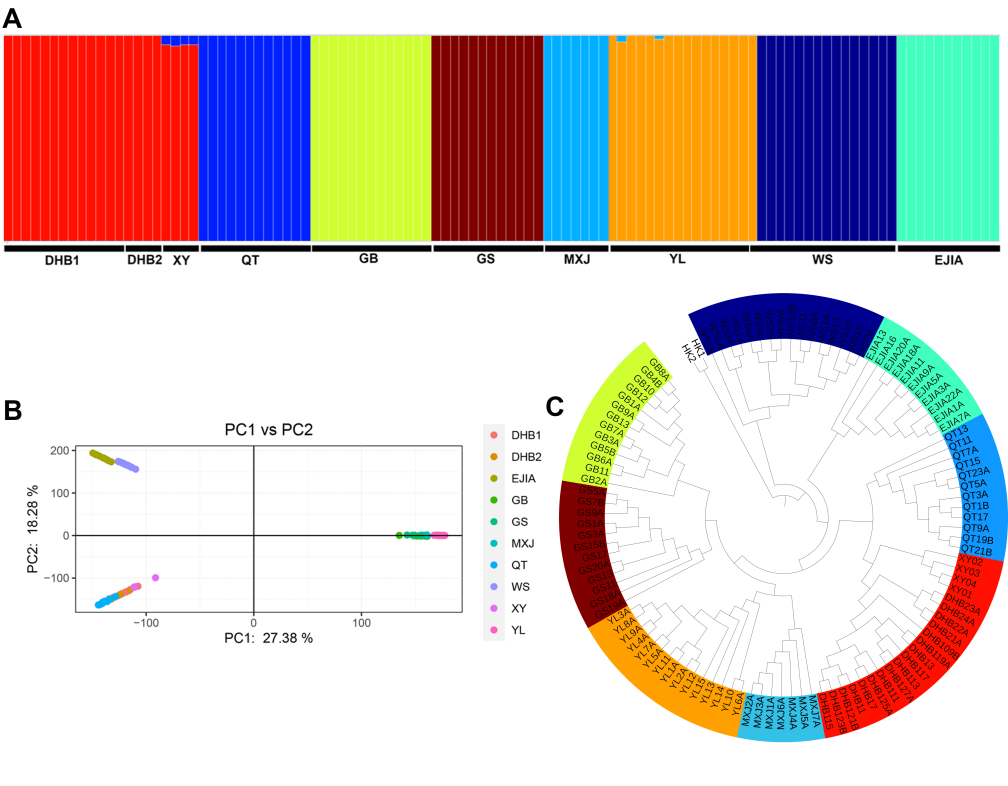
图2(A) 种群结构、基于全部位点的 (B) PCA 聚类和 (C) ML 树
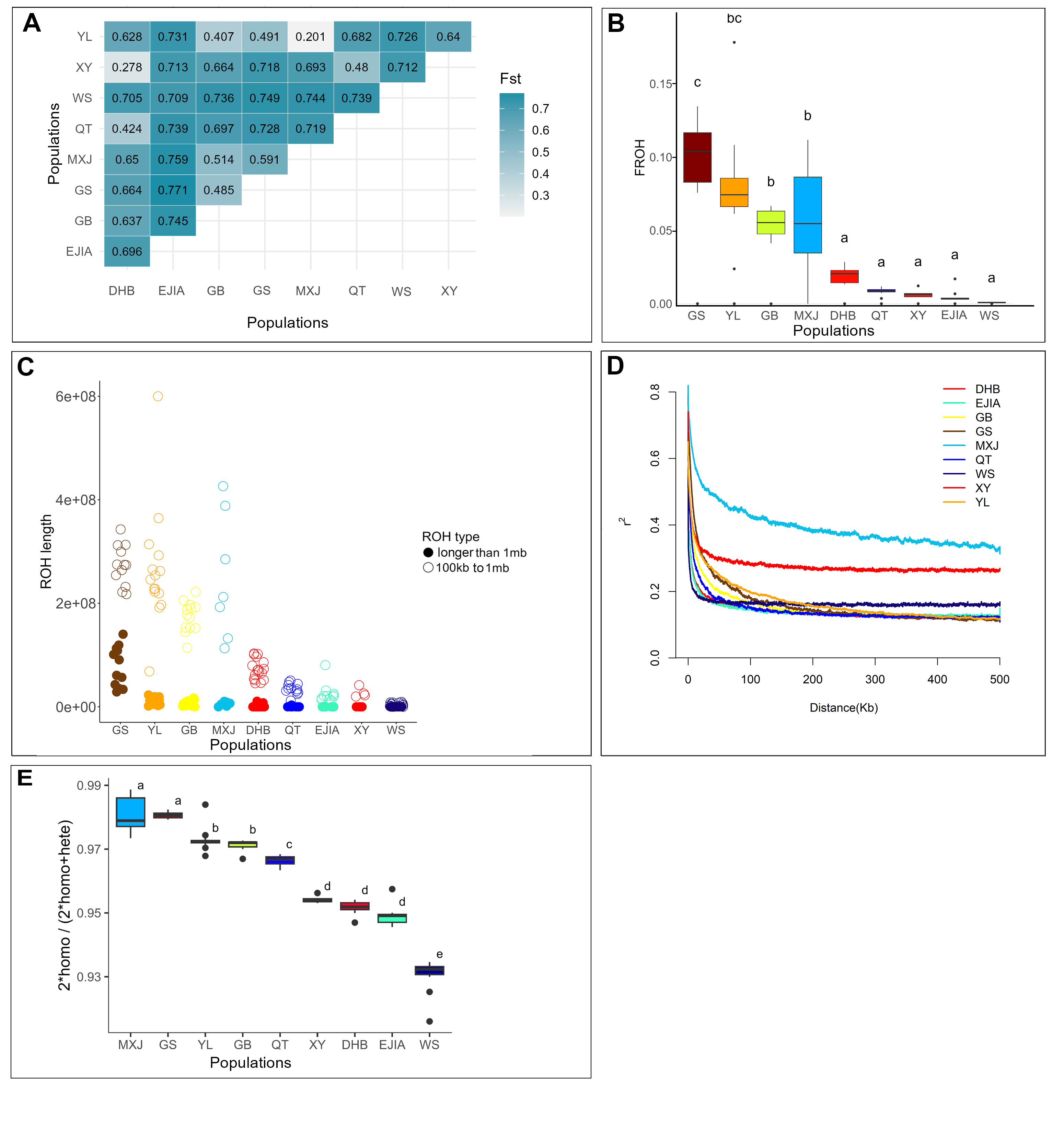 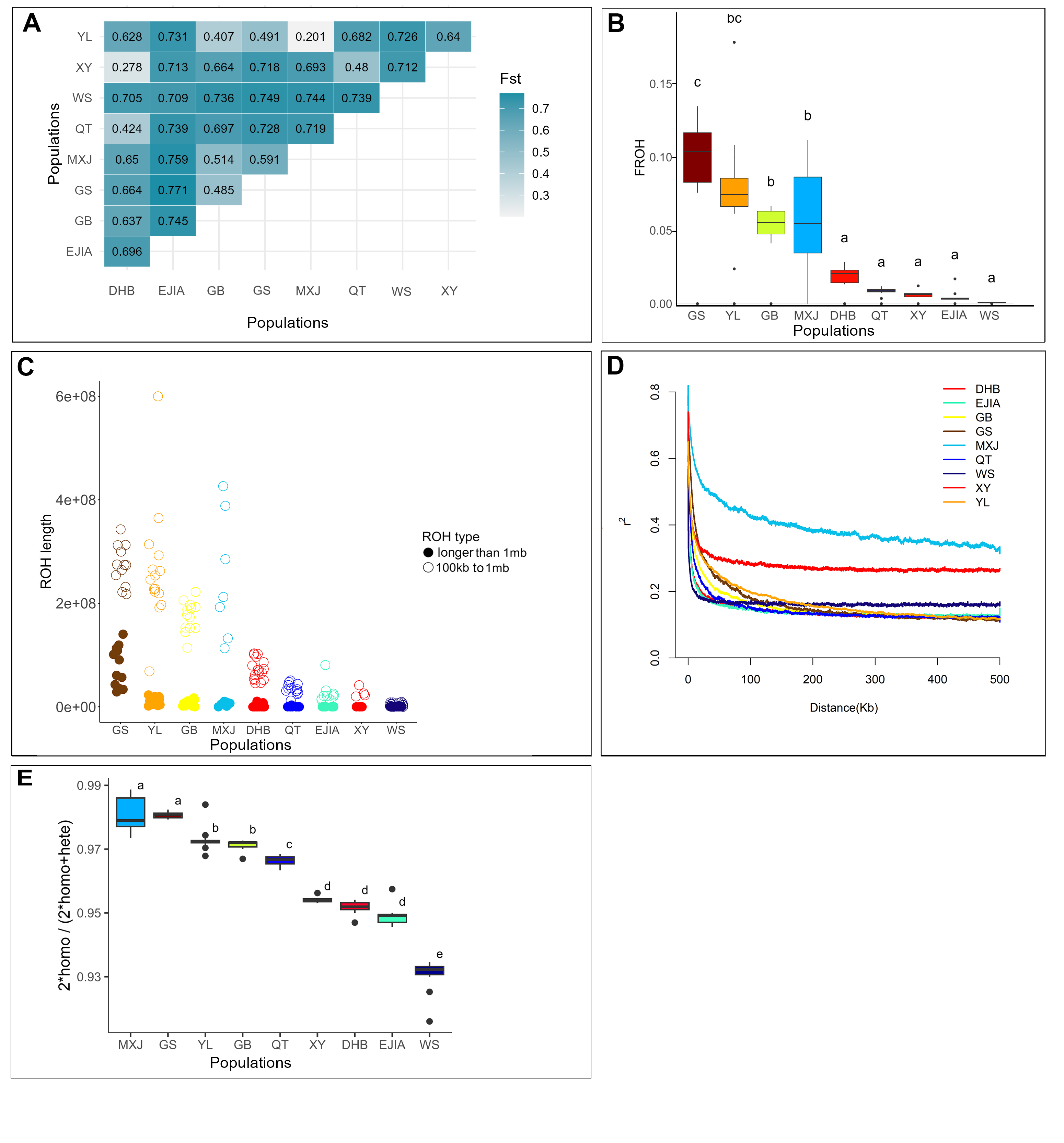
图3(A) 种群遗传分化、(B) 纯合性片段比例、(C) 纯合子片段的大小分布、(D) 全基因组连锁不平衡(LD)的衰减、(E) 群体水平的遗传负荷,纯合衍生有害突变的比例
该研究以High-quality genome of Oreocharis mileensis (Gesneriaceae) provides insights into the adaptation and conservation of highly threatened species in karst region为题在线发表在国际期刊Plant Diversity。中国科学院昆明植物所博士研究生Temur Asatulloev、蔡磊副研究员为论文的共同第一作者,中国科学院昆明植物所孙卫邦研究员、蔡磊副研究员、乌兹别克斯坦科学院植物研究所Komiljon Sh. Tojibaev院士为共同通讯作者,乌兹别克斯坦科学院植物研究所Ziyoviddin Yusupov博士、山东省农业科学院贾凯华副研究员及昆明植物所博士研究生张仁纲参与了研究。
此外,考虑到喀斯特地区植物可通过植物激素信号与防御反应调控微生物群落,研究团队还探究了弥勒苣苔如何与微生物组动态互作。研究分析了五个种群的细菌和真菌群落,以评估种群水平差异、识别耐旱微生物并评估其在种群间的保守性。研究发现:(1)微生物组成受不同区域土壤(非根际土壤bulk soil、根际土壤rhizosphere、根内圈endosphere)的影响最为强烈,但仅表现出中等程度的干旱诱导变化,这表明弥勒苣苔在胁迫下维持了相对稳定的微生物群落。核心门类(如变形菌门Proteobacteria、放线菌门Actinobacteriota、子囊菌门Ascomycota)在种群间是保守的,而属水平的核心类群则存在差异,反映了生态位特化和宿主基因型的影响。(2)喀斯特地区的干旱增加了细菌的α多样性,但降低了β多样性,表明出现了由耐胁迫类群(如放线菌门Actinobacteriota)驱动的同质化。真菌的反应则不同,其β多样性增加表明干旱增强了群落组成的更替。关键的细菌属在水分充足条件下占主导地位;而干旱则富集了放线菌门中的诸如微月形菌属(Microlunatus)和红细菌属(Rubrobacter)等以及其他耐旱类群。真菌群落从以腐生营养型为主的水合状态转变为干旱条件下以共生类群(如Paraboeremia 和柔膜菌目Helotiales)为主的状态。(3)功能注释分析显示,不同区室具有特异性的代谢功能:干旱则显著富集了胁迫响应通路,如次级代谢物生物合成和信号转导。
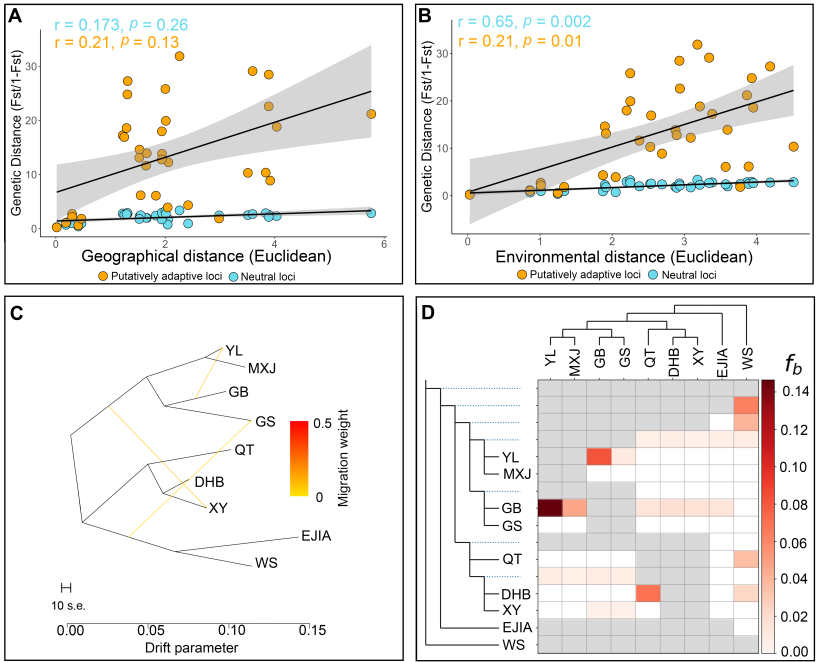 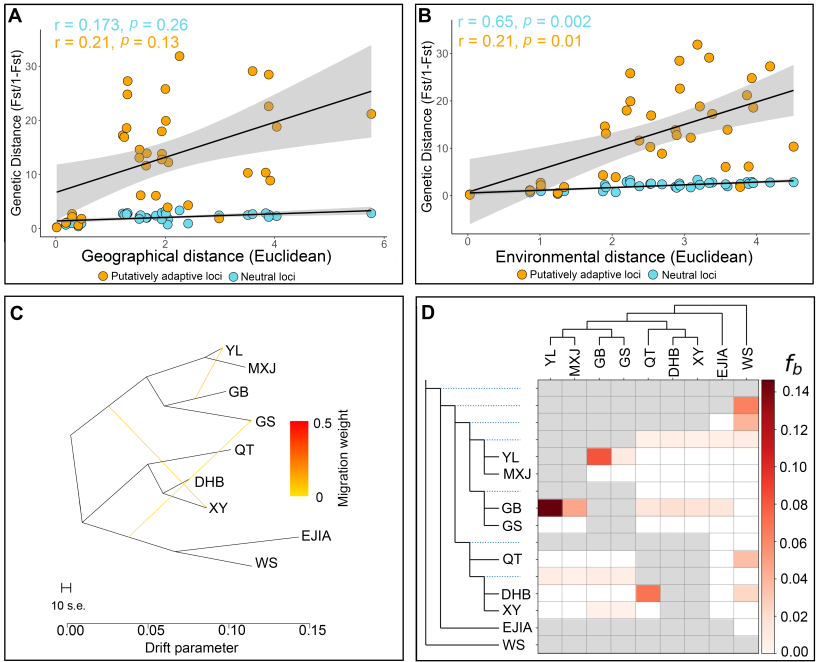
图4(A) 中性位点和适应性位点的距离隔离(IBD)、(B) 环境隔离(IBE)、(C) 种群关系与推断的基因流、(D) Dsuite热图显示种群间的基因渐渗
 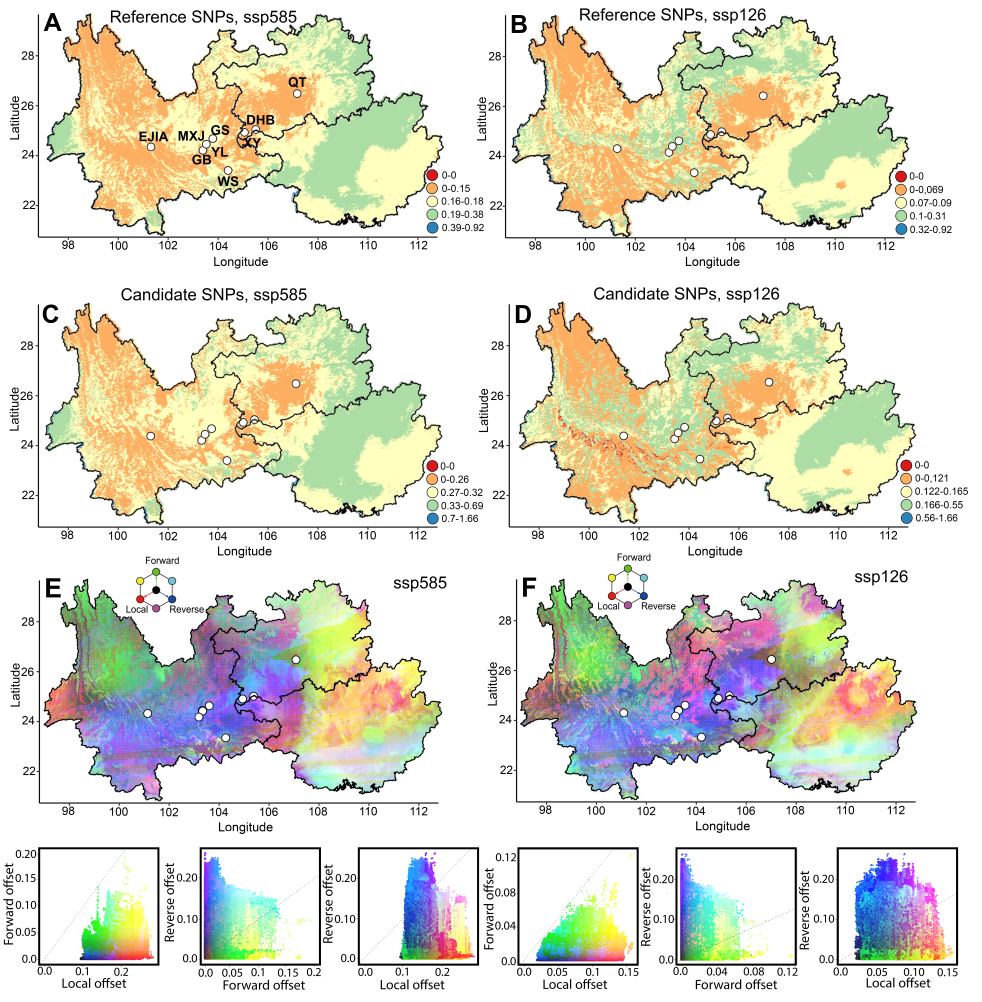
图5 在SSP585和SSP126情景下,使用参考SNP(A, B)和适应性SNP(C, D)对2100年的遗传偏移进行预测、(E)SSP585和(F)SSP126下多维偏移的RGB可视化
 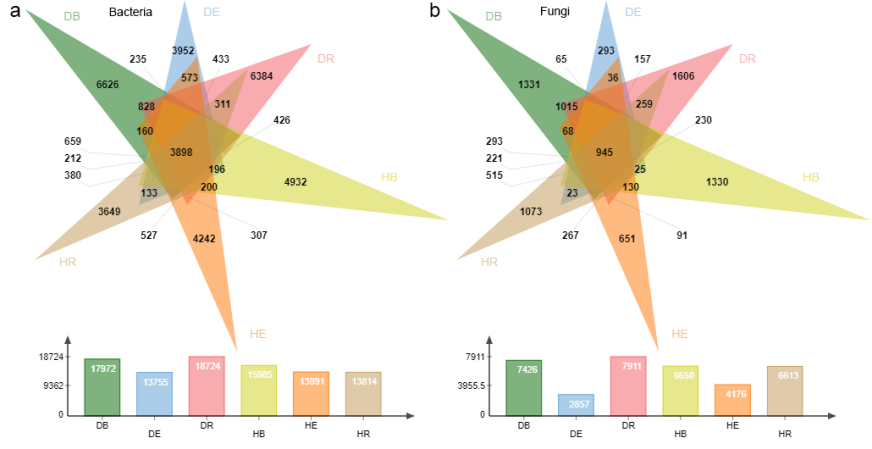
图6 维恩图展示了样本中细菌(a)和真菌(b)OTU的重叠情况
 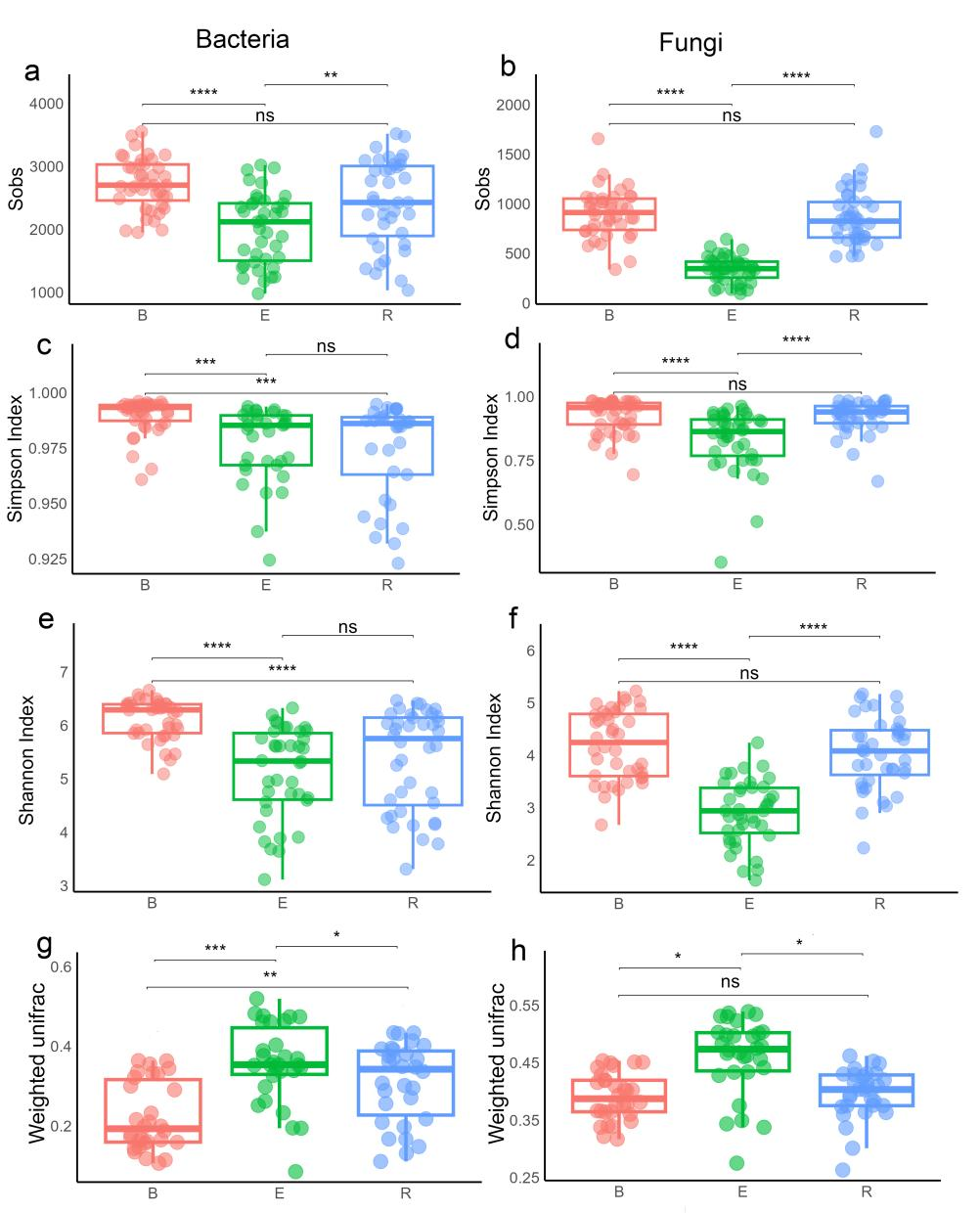
图7 不同组织微生物群落的α多样性和β多样性:细菌(a)和真菌(b)群落的Sobs多样性指数;细菌(c)和真菌(d)群落的Simpson多样性指数;细菌(e)和真菌(f)群落的Shannon多样性指数;基于加权UniFrac距离矩阵的细菌(g)和真菌(h)群落的Beta多样性
该研究为极小种群野生植物弥勒苣苔的紧急保护提供了关键依据。首先,研究鉴定出能增强植物生存能力的耐旱和促进生长的共生微生物,这些有益微生物或可用于提高迁地栽培和回归植株的恢复力;其次,研究团队记录了跨种群的稳定核心微生物群落,表明在原生境保护中,土壤微生物组的保护应与植物保护同等优先;第三,功能分析揭示了参与胁迫耐受性的微生物通路,为监测不断变化的环境中的植物健康提供了潜在的生物标志物。这些研究结果通过鉴定弥勒苣苔的关键微生物组分维持其种群,为制定保护策略提供了直接依据。
该研究以Comparative root associated microbial community analysis of Oreocharis mileensis, a resurrection plant species with extremely small populations为题发表在国际期刊Frontiers in Microbiology。中国科学院昆明植物所Temur Asatulloev博士研究生为论文的第一作者,中国科学院昆明植物所孙卫邦研究员、蔡磊副研究员、乌兹别克斯坦科学院植物研究所Komiljon Sh. Tojibaev院士为共同通讯作者,乌兹别克斯坦科学院植物研究所Ziyoviddin Yusupov博士、昆明植物所陈秋平博士和Bishal Gurung博士参与了研究。
基于以上多维度研究结果,研究团队提出了弥勒苣苔具体的保护策略。包括划定八个基于遗传信息的管理单元(广西大哄豹DHB和贵州兴义XY种群为一个单元,其余每个种群各为一个独立单元),促进相容种群间的辅助基因流,并对高度隔离的种群实施迁地保护、栖息地恢复等以缓解遗传侵蚀并增强适应性恢复力。研究团队还建议将微生物组评估纳入现有保护计划,并应用微生物强化技术以增强迁地保护成效。这一聚焦微生物的方法为保护该濒危物种应对气候变化与生境退化提供了新视角。总体而言,这两项研究深入解析了脆弱喀斯特生态系统中支配物种存续的进化驱动力与植物-微生物组互作机制,并提出了一个可操作的综合性的保护框架。以上研究工作得到了国家重点研发计划(2024YFF1307400)、云南省重点研发计划(202403AC100028)、云南省基础研究计划(202301AT070318)等项目的支持。
文章链接1
文章链接2
|

